Nat Med |O abordare multi-omică pentru cartografierea peisajului integrat tumoral, imunitar și microbian al cancerului colorectal dezvăluie interacțiunea microbiomului cu sistemul imunitar
Deși biomarkerii pentru cancerul primar de colon au fost studiați pe larg în ultimii ani, ghidurile clinice actuale se bazează doar pe stadializarea metastazelor tumorale-ganglioni limfatici și pe detectarea defectelor de reparare a nepotrivirii ADN (MMR) sau a instabilității microsateliților (MSI) (în plus față de testarea patologică standard). ) pentru a determina recomandări de tratament.Cercetătorii au observat o lipsă de asociere între răspunsurile imune bazate pe expresia genelor, profilurile microbiene și stroma tumorală în cohorta de cancer colorectal din Atlasul genomului cancerului (TCGA) și supraviețuirea pacientului.
Pe măsură ce cercetarea a progresat, s-a raportat că caracteristicile cantitative ale cancerului colorectal primar, inclusiv natura cancerului celular, imun, stromal sau microbian a cancerului, au fost raportate că se corelează semnificativ cu rezultatele clinice, dar există încă o înțelegere limitată a modului în care interacțiunile lor afectează rezultatele pacienților. .
Pentru a diseca relația dintre complexitatea fenotipică și rezultat, o echipă de cercetători de la Institutul de Cercetare Medicală Sidra din Qatar a dezvoltat și validat recent un scor integrat (mICRoScore) care identifică un grup de pacienți cu rate bune de supraviețuire, combinând caracteristicile microbiomului și respingerea imunității. constante (ICR).Echipa a efectuat o analiză genomică cuprinzătoare a probelor proaspete congelate de la 348 de pacienți cu cancer colorectal primar, inclusiv secvențierea ARN a tumorilor și țesutul colorectal sănătos potrivit, secvențierea întregului exom, receptorul celulelor T profunde și secvențierea genei ARNr bacteriană 16S, suplimentată de întreaga tumoră. secvențierea genomului pentru a caracteriza în continuare microbiomul.Studiul a fost publicat în Nature Medicine ca „Un atlas integrat de tumoră, imunitate și microbiom al cancerului de colon”.

Articol publicat în Nature Medicine
Prezentare generală AC-ICAM
Cercetătorii au folosit o platformă genomică ortogonală pentru a analiza probe de tumori proaspete congelate și au comparat țesutul colonului sănătos adiacent (perechi tumori-normale) de la pacienți cu un diagnostic histologic de cancer de colon fără terapie sistemică.Pe baza secvențierii întregului exom (WES), controlul calității datelor ARN-seq și screening-ul criteriilor de includere, datele genomice de la 348 de pacienți au fost reținute și utilizate pentru analiza în aval, cu o urmărire mediană de 4,6 ani.Echipa de cercetare a numit această resursă Sidra-LUMC AC-ICAM: O hartă și ghid pentru interacțiunile imun-cancer-microbiom (Figura 1).
Clasificarea moleculară folosind ICR
Capturând un set modular de markeri genetici imuni pentru imunosupravegherea continuă a cancerului, numit constanta imună a respingerii (ICR), echipa de cercetare a optimizat ICR prin condensarea acestuia într-un panou de 20 de gene care acoperă diferite tipuri de cancer, inclusiv melanomul, cancerul vezicii urinare și cancer mamar.ICR a fost, de asemenea, asociat cu răspunsul la imunoterapie într-o varietate de tipuri de cancer, inclusiv cancerul de sân.
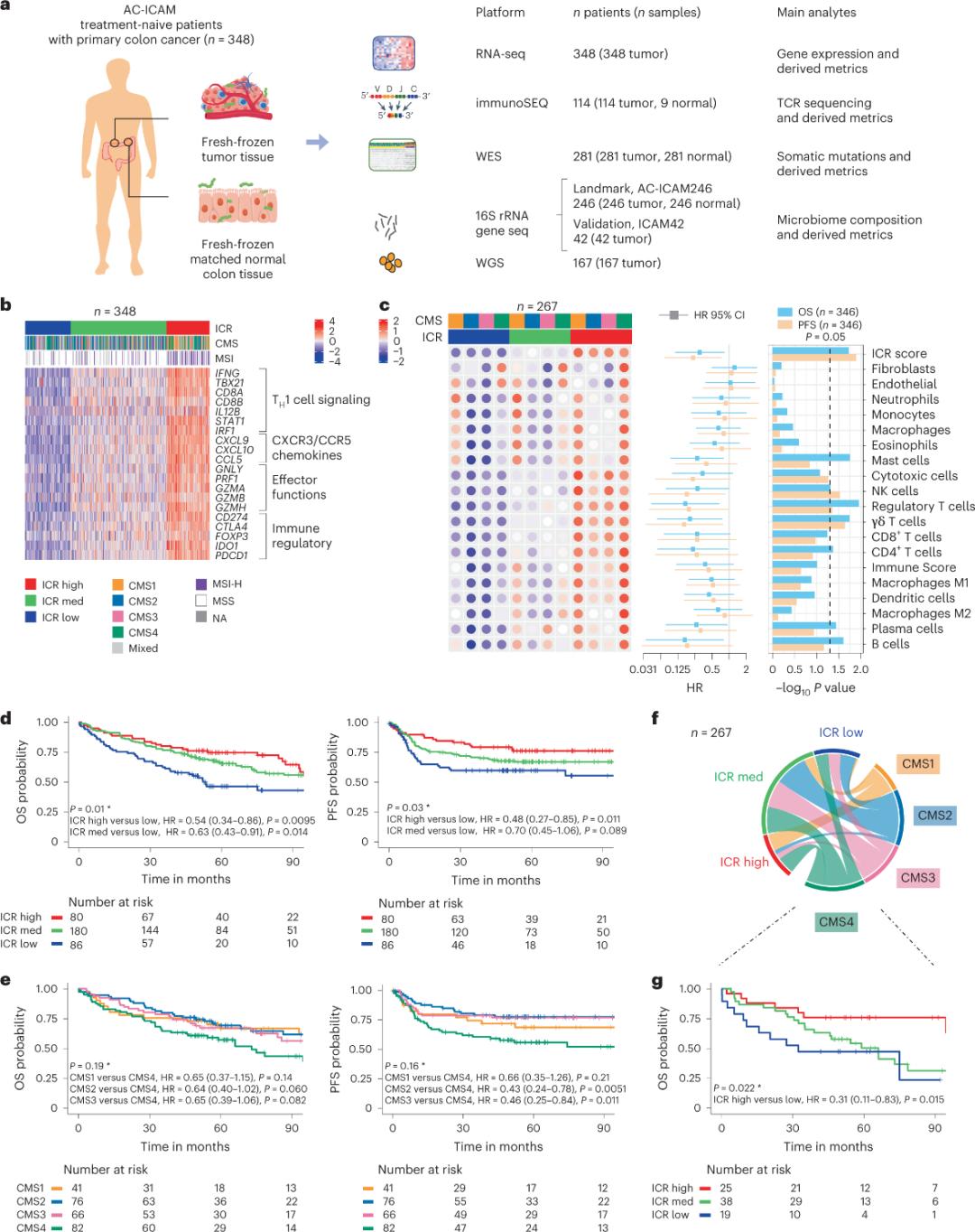
În primul rând, cercetătorii au validat semnătura ICR a cohortei AC-ICAM, folosind o abordare de co-clasificare bazată pe gene ICR pentru a clasifica cohorta în trei grupuri/subtipuri imune: ICR ridicat (tumori fierbinți), ICR mediu și ICR scăzut (rece). tumori) (Figura 1b).Cercetătorii au caracterizat tendința imună asociată cu subtipurile moleculare consensuale (CMS), o clasificare bazată pe transcriptom a cancerului de colon.categoriile CMS au inclus CMS1/imun, CMS2/canonic, CMS3/metabolic și CMS4/mezenchimal.Analiza a arătat că scorurile ICR au fost corelate negativ cu anumite căi de celule canceroase în toate subtipurile CMS, iar corelații pozitive cu căile imunosupresoare și legate de stromal au fost observate numai în tumorile CMS4.
În toate CMS, abundența de celule natural killer (NK) și subseturile de celule T a fost cea mai mare în subtipurile ICR cu imunitate înaltă, cu o variabilitate mai mare în alte subseturi de leucocite (Figura 1c). Subtipurile imune ICR au avut OS și PFS diferite, cu o creștere progresivă. în ICR de la scăzut la mare (Figura 1d), validând rolul prognostic al ICR în cancerul colorectal.
Figura 1. Designul studiului AC-ICAM, semnătura genelor legate de imun, subtipurile imune și moleculare și supraviețuirea.
ICR captează celule T îmbogățite cu tumori, amplificate clonal
Doar o minoritate de celule T care infiltrează țesutul tumoral au fost raportate a fi specifice pentru antigenele tumorale (mai puțin de 10%).Prin urmare, majoritatea celulelor T intra-tumorale sunt denumite celule T spectatori (celule T spectatori).Cea mai puternică corelație cu numărul de celule T convenționale cu TCR productive a fost observată în subpopulațiile de celule stromale și leucocite (detectate de ARN-seq), care pot fi utilizate pentru a estima subpopulațiile de celule T (Figura 2a).În clusterele ICR (clasificarea generală și CMS), cea mai mare clonalitate a TCR-urilor SEQ imune a fost observată în grupurile ICR-high și CMS subtip CMS1/imun (Figura 2c), cu cea mai mare proporție de tumori ICR-high.Folosind întregul transcriptom (18.270 gene), șase gene ICR (IFNG, STAT1, IRF1, CCL5, GZMA și CXCL10) s-au numărat printre primele zece gene asociate pozitiv cu clonalitatea SEQ imună TCR (Figura 2d).Clonalitatea ImmunoSEQ TCR s-a corelat mai puternic cu majoritatea genelor ICR decât corelațiile observate folosind markeri CD8+ sensibili la tumori (Figura 2f și 2g).În concluzie, analiza de mai sus sugerează că semnătura ICR surprinde prezența celulelor T îmbogățite cu tumori, amplificate clonal și poate explica implicațiile sale prognostice.
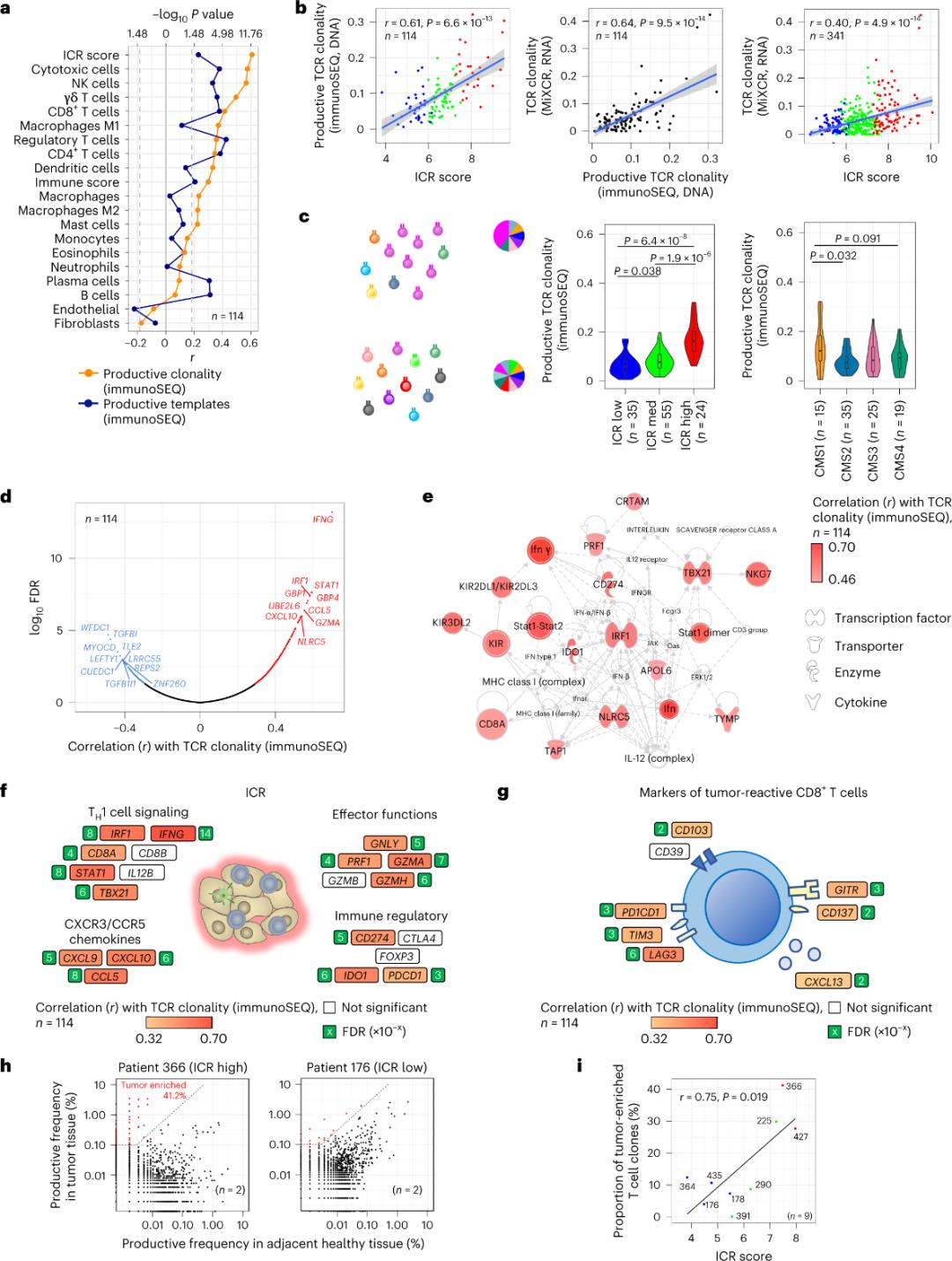
Figura 2. Metrica TCR și corelația cu genele legate de imun, subtipurile imune și moleculare.
Compoziția microbiomului în țesuturile sănătoase și canceroase de colon
Cercetătorii au efectuat secvențierea ARNr-ului 16S folosind ADN extras din tumora potrivită și țesut de colon sănătos de la 246 de pacienți (Figura 3a).Pentru validare, cercetătorii au analizat în plus datele de secvențiere a genei ARNr 16S din alte 42 de probe de tumoră care nu aveau ADN normal disponibil pentru analiză.În primul rând, cercetătorii au comparat abundența relativă a florei dintre tumorile potrivite și țesutul sănătos al colonului.Clostridium perfringens a fost semnificativ crescut în tumori în comparație cu probele sănătoase (Figura 3a-3d).Nu a existat nicio diferență semnificativă în diversitatea alfa (diversitatea și abundența speciilor într-o singură probă) între probele tumorale și sănătoase și s-a observat o reducere modestă a diversității microbiene în tumorile cu ICR ridicat în comparație cu tumorile cu ICR scăzut.
Pentru a detecta asocieri relevante din punct de vedere clinic între profilurile microbiene și rezultatele clinice, cercetătorii și-au propus să utilizeze datele de secvențiere a genei ARNr 16S pentru a identifica caracteristicile microbiomului care prezic supraviețuirea.La AC-ICAM246, cercetătorii au rulat un model de regresie OS Cox care a selectat 41 de caracteristici cu coeficienți non-zero (asociați cu riscul de mortalitate diferențial), numite clasificatori MBR (Figura 3f).
În această cohortă de formare (ICAM246), un scor MBR scăzut (MBR<0, MBR scăzut) a fost asociat cu un risc semnificativ mai scăzut de deces (85%).Cercetătorii au confirmat asocierea dintre MBR scăzut (risc) și OS prelungit în două cohorte validate independent (ICAM42 și TCGA-COAD).(Figura 3) Studiul a arătat o corelație puternică între cocii endogastrici și scorurile MBR, care au fost similare în tumoră și țesutul colonului sănătos.
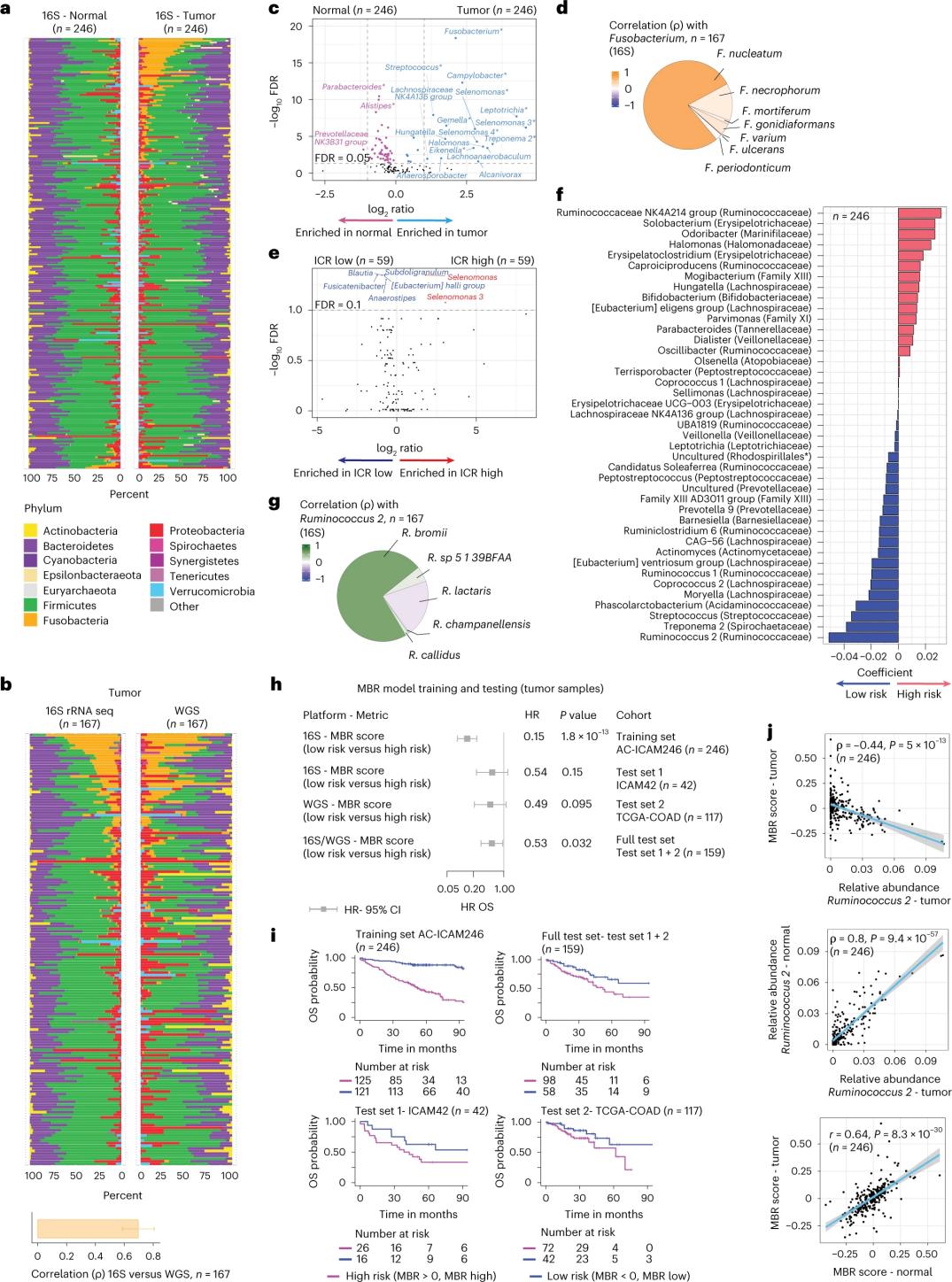
Figura 3. Microbiomul în țesuturi tumorale și sănătoase și relația cu ICR și supraviețuirea pacientului.
Concluzie
Abordarea multi-omică utilizată în acest studiu permite detectarea și analiza amănunțită a semnăturii moleculare a răspunsului imun în cancerul colorectal și dezvăluie interacțiunea dintre microbiom și sistemul imunitar.Secvențierea TCR profundă a tumorii și a țesuturilor sănătoase a dezvăluit că efectul prognostic al ICR se poate datora capacității sale de a capta clone de celule T îmbogățite cu tumori și, posibil, specifice antigenului tumoral.
Analizând compoziția microbiomului tumoral folosind secvențierea genei ARNr 16S în probele AC-ICAM, echipa a identificat o semnătură a microbiomului (scor de risc MBR) cu valoare prognostică puternică.Deși această semnătură a fost derivată din probe de tumoră, a existat o corelație puternică între colorectul sănătos și scorul de risc MBR tumoral, sugerând că această semnătură poate capta compoziția microbiomului intestinal al pacienților.Prin combinarea scorurilor ICR și MBR, a fost posibil să se identifice și să se valideze un biomarker student multi-omic care prezice supraviețuirea la pacienții cu cancer de colon.Setul de date multi-omic al studiului oferă o resursă pentru a înțelege mai bine biologia cancerului de colon și pentru a ajuta la descoperirea abordărilor terapeutice personalizate.
Ora postării: 15-jun-2023
 中文网站
中文网站